Capsicum sp.: diversidad y capsicinoides
El género Capsicum, originario del continente americano (Andrews, 1984), comprende 33 especies (GRIN, 2014), de las cuales cinco, Capsicum annuum L., C. baccatum L., C. chinense Jacq., C. frutescens L., y C. pubescens Ruiz & Pav., han sido domesticadas (Bosland, 1994; Bosland y Votaba, 2000). De ellas, C. annuum es la especie más cultivada en todo el mundo. Los restos más antiguos identificados como C. annuum, que podrían corresponder a las primeras evidencias de su domesticación, se encontraron en dos estados de Méjico: Puebla y Tamaulipas, en el Valle de Tehuacán (Smith 1967, 1987) y en las cuevas de Ocampo (Mangelsdorf et al., 1965), respectivamente. Recientemente, se ha propuesto que la domesticación de esta especie pudo tener lugar en una o dos áreas de Méjico, concretamente en la zona noroeste y central-este de Méjico (Kraft et al., 2014).
Diversidad de Capsicum sp.
Las diferentes especies de Capsicum comenzaron a ser introducidas en Europa a finales del siglo XV. Llegaron primero a la Península Ibérica, desde donde se distribuyeron, primero, hacia el resto de Europa y posteriormente, a África, a India y a China (Bosland y Votava, 2000). La domesticación y selección a la que fueron sometidas las distintas especies por los agricultores durante cientos de años, así como, el amplio abanico de condiciones agro-ambientales en las que fueron cultivadas, ha hecho, que en la actualidad, haya una gran variabilidad morfológica de cultivares de pimiento en cuanto a su forma, tamaño y colores, entre otras características (Nuez et al., 1996). En los programas de mejora de pimiento se aprovecha esta amplia variabilidad para obtener nuevas variedades que respondan a las demandas del sector agrícola y de los consumidores. Para ello, es esencial, disponer de una detalla caracterización geográfica, morfológica y molecular de la diversidad de Capsicum. En este sentido, se han realizado trabajos de caracterización de distintas colecciones de germoplasma de pimiento. A nivel morfológico se han analizado los principales descriptores cuantitativos y cualitativos para este género (Villota-Cerón et al 2012; Occhiuto et al 2014; Carvalho et al 2014; Bozokalfa y Eşiyok, 2011).

A nivel molecular se han utilizado distintos tipos de marcadores moleculares, como RFLPS, RAPDS, AFLPS y SSRs, para estudiar el nivel de variabilidad genética, así como las relaciones genéticas, de entradas de Capsicum de distintas colecciones de germoplasma (Lefebvre et al., 1993; Paran et al., 1998; Ibiza et al. 2011; González-Pérez et al., 2014). La reciente secuenciación del genoma del pimiento (Qin et al., 2014; Kim et al., 2014) es una oportunidad para los mejoradores para continuar los estudios de variabilidad genética y evolución de las especies, así como, para profundizar en el conocimiento del control genético de importante caracteres de mejora como la calidad y las resistencias a estreses bióticos y abióticos.
Los capsicinoides son los responsables de picor de los pimientos
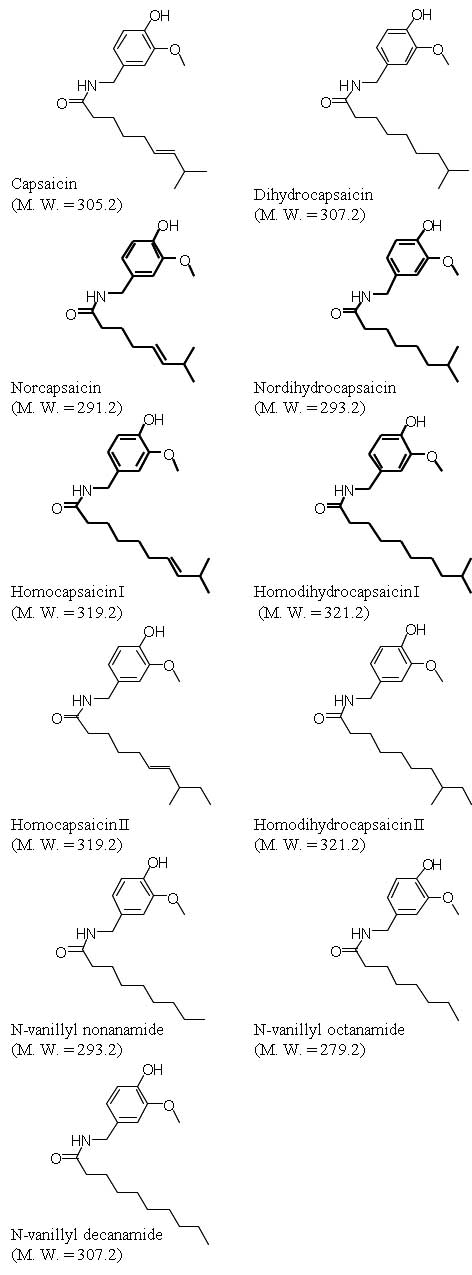
Los capsicinoides son compuestos alcaloides que pertenecen al metabolismo secundario de la planta de pimiento. La biosíntesis de estos compuestos es única del género Capsicum y comienza a partir de los 20 días post-antesis, acumulándose en unas vesículas localizadas a lo largo de la epidermis del tejido placentario de los frutos de pimiento (Iwai et al., 1979; Ohta, 1962; Suzuki et al., 1980; Zamski et al., 1987). Estos compuestos son los responsables del carácter picante de los frutos y aunque se han descrito al menos 11 compuestos, la capsicina es el mayoritario, seguido por la dihidrocapsicina (Reilly et al. 2001; Maillard et al. 1997). Ambos compuestos pueden representar hasta el 80% del total del contenido de capsicinoides. La condensación catalizada, por la capsicina sintetasa (CS), entre un anillo aromático y una cadena de ácidos grasos de entre 9 y 11 C da lugar a estos compuestos. El anillo aromático es la vanillilamina, que deriva de la fenilalanina. La cadena de ácidos grasos se biosintetiza a partir de los aminoácidos valina y leucina (Bennett and Kirby, 1968; Leete y Louden, 1968; Sukrasno y Yeoman, 1993; Suzuki et al., 1981). Los distintos capsicinoides difieren en la longitud de la cadena, su saturación y la posición del metilo terminal (Figura 1).
La presencia de estos compuestos en los frutos podría haber facilitado la dispersión de las especies de Capsicum, ya que actúa como un mecanismo de defensa y disuasivo contra los pequeños mamíferos que intentan comerse los frutos, evitando su desaparición. No sucede lo mismo con los pájaros, que al no percibir el picor, los consumen y distribuyen las semillas consumidas, siendo la tasa de germinación de estas semillas similar a la de las semillas sin consumir y nula para aquellas consumidas por pequeños mamíferos (Tewksbury y Nabhan, 2001).
El carácter picante, así como el nivel de picor, depende de la especie de Capsicum y de la variedad. Aunque hay que tener en cuenta que el perfil de capsiciones no es un criterio taxonómico para distinguir las especies de Capsicum (Zewdie y Bosland, 2001). Hay algunas especies de Capsicum que son polimórficas para el carácter picante, ya que producen tanto frutos picantes como no picantes, como sucede con C. chacoense. Estudios realizados por Haak et al., (2011), en diferentes poblaciones naturales de frutos picantes y no picantes de C. chacoense, proponen que la presencia de plantas picantes está limitada por su adaptación a la regiones secas y depende de la eficiencia del uso del agua y de la densidad de estomas. Es decir, la relación densidad de estomas/picor limitaría la evolución del carácter picante en las poblaciones. Por otro lado, el contenido de capsicinoides varía a lo largo del desarrollo del fruto (Díaz et al., 2004; Estrada et al., 2000) y está fuertemente influenciado por el ambiente (Blum et al., 2003; Garcés-Claver et al., 2007b; Harvell y Bosland, 1997; Zewdie y Bosland, 2000b).
El control genético del carácter picante está determinado por el gen dominante C, localizado en el mapa de pimiento en el cromosoma 2 (Blum et al., 2002) y co-localizado con el gen Pun1/AT3. Este gen codifica para una aciltransferasa, la cual ha sido propuesta para ser la capsicina sintetasa (CS), responsable del último paso catalítico de la biosíntesis de los capsicinoides (Arce-Rodríguez y Ochoa-Alejo, 2015; Stewart et al., 2005, 2007). Del gen Pun1, se han identificado tres alelos mutantes que confieren la característica de no picante: pun11, pun12 y pun13. El alelo, pun11, se ha identificado exclusivamente en C. annuum y es el utilizado habitualmente en los programas de mejora para seleccionar los genotipos no picantes (Stewart et al., 2005). Los alelos pun12 (Stewart et al., 2007) y pun13 no llegan a traducirse a proteínas (Stellari et al., 2010) y se han encontrado en otras especies.
Para la identificación molecular del carácter picante se han desarrollado distintos marcadores moleculares. El marcador molecular alelo especifico Map1 discrimina entre individuos picantes y no, pertenecientes a distintas especies de Capsicum (Rodríguez-Maza et al., 2012; Garcés-Claver et al., 2007a). También, se han desarrollado marcadores para identificar los distintos alelos de Pun1 (Wyatt et al., 2012).

El contenido de capsicinoides es un carácter que se hereda cuantitativamente (Zewdie y Bosland, 2000a, b). Pocos estudios se han llevado a cabo para comprender mejor el control genético de la biosíntesis de los capsicinoides. En uno de ellos, se detectó el QTL mayor, cap, en el cromosoma 7 (Blum et al., 2003), que posteriormente, fue relacionado con el QTL ndhc7a.1, identificado por afectar al contenido de la nordihidrocapsicina (Ben-Chaim et al., 2006). En este mismo trabajo también se detectó el QTL cap3.1, afectando a los contenidos de capsicina y total de capsicinoides.
La evaluación del contenido de capsicinoides es de gran interés, en primer lugar, para los mejoradores de pimiento, ya que es un carácter a tener en cuenta en los procesos de selección de los programas de mejora de Capsicum. En segundo lugar, para las industrias del sector agroalimentario, dado el interés que despierta el picante y que ha hecho que los pimientos sean tan populares y consumidos. Y finalmente, en el sector farmacéutico, por sus características analgésicas y antitumorales (Caterina et al., 1997, 2000; Huang et al., 2013).

Fruto abierto de la variedad Habanero naranja (C. chinense). Su estado de desarrollo es de 20 días postantesis, donde ya se han comenzado a biosintetizar los capsicinoides. En la foto se observa la placenta y septos.
El primer método que se utilizó para evaluar el picante en pimiento fue el Test Scoville (Scoville, 1912), que estimaba, a través de medidas organolépticas, el contenido total de capsicinoides utilizando las denominadas Unidades Scoville. Este método, aunque popular, es impreciso y subjetivo. Posteriormente, una vez se identificaron las principales moléculas responsables del picor, la capsicina y la dihidrocapsicina (Bennett y Kirby, 1968), se desarrollaron metodologías analíticas para cuantificarlas, como la colorimetría (Gibbs y O'Garro 2004), espectrofotometría (Mori et al., 1976; Ramos, 1979; Bajaj, 1980; Rymal et al., 1984) y la cromatografía de papel (Trejo-González y Tamirano, 1973). El desarrollo y aplicación de otras técnicas analíticas ha permitido separar e identificar otros capsicinoides, como la nordihidrocapsicina y los isómeros de la homocapsicina y homodihidrocapsina, entre otros. Estas técnicas analíticas son: la cromatografía de gases (Todd et al., 1977; Iwai et al., 1979; Hawer et al., 1994); y, principalmente, la cromatografía líquida de alta resolución (HPLC) acoplada a distintas técnicas de detección como ultravioleta visible (UV-vis) (Collins et al., 1995; Maillard et al., 1997) y espectrometría de masas (Garcés-Claver et al., 2007b). Esta última técnica es la que permite una mayor selectividad y sensibilidad en la detección de los distintos capsicinoides. La aplicación de este método ha permitido cuantificar la variabilidad de este carácter, encontrando valores desde 2,3 mg de dihicrocapsicina/kg de fruto seco y cero de capsicina, para la variedad ‘Sincap’ (C. annuum), hasta 6.639 mg de capsicina/ kg de fruto seco y 3.725 mg de dihidrocapsicina/ kg de fruto seco en la variedad ‘Habanero naranja’ (C. chinense).
Referencias bibliográficas
- Andrews, J. 1984. Peppers: The domesticated Capsicums. Austin: University of Texas Press.
- Arce-Rodríguez; Ochoa-Alejo. 2015. Silencing AT3 gene reduces the expression of pAmt, BCAT, Kas, and Acl genes involved in capsaicinoid biosynthesis in chili pepper fruits. Biología Plantarum. DOI: 10.1007/s10535-015-0525-y. En prensa.
- Bajaj, K.L. 1980. Colorimetric determination of capsaicin in Capsicum fruits. J. Assoc. Off. Anal. Chem. 63: 1314-1316.
- Ben-Chaim, A.; Borovsky, Y.; Falise, M.; Mazourek, M.; Kang, B.C.; Paran, I.; Jahn, M. 2006. QTL analysis for capsaicinoid content in Capsicum. Theor. Appl. Genet. 113: 8; 1481-1490.
- Bennett, D.J.; Kirby, G.W. 1968. Constitution and biosynthesis of capsaicin. J. Chem. Soc. C: 442–446.
- Blum, E.; Liu, K.; Mazourek, M.; Yoo, E.Y.; Jahn, M.; Paran, I. 2002. Molecular mapping of the C locus for presence of pungency in Capsicum. Genome 45: 702-705.
- Blum, E.; Mazourek, M.; O’Connell, M.A.; Curry, J.; Thorup, T.; Liu, K.; Jahn, M.M.; Paran, I. 2003. Molecular mapping of capsaicinoid biosynthesis genes and quantitative trait loci analysis for capsaicinoid content in Capsicum. Theor. Appl. Genet. 108: 79–86.
- Bosland, P.W. 1994. Chiles: History, cultivation and uses. Spices, Herbs and Edible Fungi, ed Charambous G (Elsevier, New York).
- Bosland, P.W.; Votava, E.J. 2000. Peppers: vegetable and spice Capsicum. CABI Publishing, Oxon. 204p
- Bozokalfa, M.K.; Eşiyok, D. 2011. Evaluation of morphological and agronomical characterization of turkish pepper accessions. International Journal of Vegetable Science, 17(2):115-135
- Carvalho, S.I.C.; Faleiro, F.G.; Ragassi, C.F.; Bianchetti, L.B.; Buso, G.S.C.; Reifschneider, F.J.B. 2014. Morphological and genetic relationships between wild and domesticated forms of peppers (Capsicum frutescens L. and C. chinense Jacquin). Genetics and Molecular Research, 13(3):7447-7464
- Caterina, M.J.; Schumacher, M.A.; Tominaga, M.; Rosen, T.A.; Levine, J.D.; Julius, D. 1997. The capsaicin receptor: a heat- activated ion channel in the pain pathway. Nature, 389: 816–824.
- Caterina, M.J.; Leffler, A.; Malmberg, A.B.; Martin, W.J.; Trafton, J.; Petersen-Zeitz, K.R.; Koltzenburg, M.; Blasbaum, A.I.; Julius, D. 2000. Impaired nociception and pain sensation in mice lacking the capsaicin receptor. Science, 288: 306–313.
- Collins, M. D.; Wasmund, L. M.; Bosland, P. W. 1995. Improved method for quantifying capsaicinoids in Capsicum using highperformance liquid chromatography. HortScience 30: 137-139.
- Díaz, J.; Pomar, F.; Bernal, A.; Merino, F. 2004. Peroxidases and the metabolism of capsaicin in Capsicum annuum L. Phytochem Rev 3:141–157
- Estrada, B.; Bernal, M.A.; Diaz, J.; Pomar, F.; Merino, F. 2000. Fruit development in Capsicum annuum: Changes in capsaicin, lignin, free phenolics, and peroxidase patterns. J Agric Food Chem 48: 6234–6239.
- Garcés-Claver, A; Fellman, SM; Gil-Ortega, R; Jahn, M; Arnedo-Andres, MS. 2007a. Identification, validation and survey of a single nucleotide polymorphism (SNP) associated with pungency in Capsicum spp. Theor. Appl. Genet. 115(7): 907-916
- Garcés-Claver, A.; Gil-Ortega, R.; Álvarez-Fernández A.; Arnedo-Andrés, M.S. 2007b. Inheritance of capsaicin and dihydrocapsaicin, determined by HPLC-ESI/MS, in an intraspecific cross of Capsicum annuum L. J. Agr. Food Chem. 55: 6951-6957.
- Gibbs, H.A.A.; O'Garro, L.W.O. 2004. Capsaicin content of West Indies hot pepper cultivars using colorimetric and chromatographic techniques. HortScience, vol. 39(1): 132–135.
- González-Pérez, S.; Garcés-Claver, A.; Mallor, C.; Saenz de Miera, L.E.; Fayos, O.; Pomar, F.; Merino, F.; Silvar, C. 2014. New Insights into Capsicum spp relatedness and the diversification process of Capsicum annuum in Spain. PLoS ONE 9(12):e116276.
- GRIN. 2014. National Plant Germplasm System: Peppers. Germplasm Resources Information Network http://www.ars-grin.gov/npgs/stats/.
- Haak, D.; McGinnis, L.; Levey, D.: Tewksbury, J. 2011. Why are not all chilies hot? A trade-off limits pungency. Proceedings of the Royal Society B: Biological Sciences. DOI: 10.1098/rspb.2011.2091
- Harvell, K.P.; Bosland, P.W. 1997. The environment produces a significant effect on pungency of chiles. Hortscience, 32: 1292.
- Hawer, W.S.; Ha, J.; Hwang, J.; Nam, Y. 1994. Effective separation and quantitative analysis of major heat principles in red pepper by capillary gas chromatography. Food Chem., 63: 1314-1316
- Huang, X.F.; Xue, J.Y.; Jiang, A.Q.; Zhu, H.L.; 2013. Capsaicin and its analogues: structure-activity relationship study. Current Medicinal Chemistry, 20(21): 2661–2672.
- Ibiza, V.P.; Blanca, J.; Cañizares, J.; Nuez, F. 2011. Taxonomy and genetic diversity of domesticated Capsicum species in the Andean región. Genetic Resources and Crop Evolution 59: 1077-1088.
- Iwai, K.; Suzuki, T.; Fujiwake, H.; Oka, S. 1979. Simultaneous microdetermination of capsaicin and its four analogues by using high-performance liquid chromatography and gas chromatography-mass spectrometry. Journal of Chromatography A, 172(1): 303–311
- Kim, S.; Park, M.; Yeom, S.I.; et al., 2014. Genome sequence of the hot pepper provides insights into the evolution of pungency in Capsicum species. Nat Genet. 46(3):270-8.
- Kraft, K.H.; Brown, C.H.; Nabhan, G.P.; Luedeling, E.; Luna Ruiz, J.J.; Coppens d’Eeckenbrugge, G.; Hijmans, R.J.; Gepts, P. 2014. Multiple lines of evidence for the origin of domesticated chili pepper, Capsicum annuum, in Mexico. Proc Natl Acad Sci. 111(17): 6165–6170.
- Leete, E.; Louden, M.C.L. 1968. Biosynthesis of capsaicin and dihydrocaspaicin in Capsicum frutescens. J. Am. Chem. Soc. 90: 6837–6841.
- Lefebvre, V.; Palloix, A.; Rives, M. 1993. Nuclear RFLP between pepper cultivars (Capsicum annuum L.). Euphytica 71: 189–199.
- Maillard, M.N.; Giampaoli, P.; Richard, H.M.J. 1997. Analysis of eleven capsaicinoids by reversed-phase high performance liquid chromatography. FlaVour Fragrance J. 12: 409-413.
- Mangelsdorf, P.C.; McNeish, R.S.; Willey, G.R. 1965. Origins of Middle American agriculture. Natural Environment and Early Cultures, ed West RC (Univ. of Texas Press, Austin, Texas), pp 427–445.
- Mori, K.; Sawada, H.; Nishiura, Y. 1976. Determination of pungent principles in Capsicum pepper. J. Jpn. Soc. Food Sci. Technol., 23: 199-205.
- Nuez, F.; Gil, R.; Costa, J. 1996. El cultivo de pimientos, chiles y ajies. Mundi-Prensa, Madrid. 607 p.
- Occhiuto, P.N.; Peralta, I.E.; Asprelli, P.D.; Galmarini, C.R. 2014. Characterization of Capsicum germplasm collected in northwestern Argentina based on morphological and quality traits. AgriScientia, 31(2):63-73
- Ohta, Y. 1962. Physiological and genetical studies on the pungency of Capsicum, IV. Secretory organs, receptacles and distribution of capsaicin in the Capsicum fruit. Jpn. J. Breed. 12, 43–47.
- Paran, I.; Aftergoot, E.; Shifriss, C. 1998. Variation in Capsicum annuum revealed by RAPD and AFLP markers. Euphytica 99: 167–173.
- Qin, C.; Yu, C.; Shen, Y.; Fang, X.; et al., 2014. Whole-genome sequencing of cultivated and wild peppers provides insights into Capsicum domestication and specialization. PNAS. 111(14): 5135–5140,
- Ramos, P.J. 1979. Further study of the spectrophotometric determination of capsaicin. J. Assoc. Off. Anal. Chem. 62: 1168-1170.
- Reilly, C.A.; Crouch, D.J.; Yost, G.S. 2001. Quantitative analysis of capsaicinoids in fresh peppers, oleoresin capsicum and pepper spray products. J Forensic Sci 46:502–509.
- Rodríguez-Maza, M.; Garcés-Claver, A.; Park, S.W.; Kang, B.C.; Arnedo-Andres, M.S. 2012. A versatile PCR marker for pungency in Capsicum spp. Mol Breed 30:889–898.
- Rymal, K.S.; Cosper, R.D.; Smith, D.A. 1984. Injection-extraction procedure for rapid determination of relative pungency in fresh jalapeño peppers. J. Assoc. Off. Anal. Chem., 67: 658-659.
- Scoville, W.L. 1912. Note on capsicums. Journal of the American Pharmaceutical Association, 1(5): 453–454.
- Smith, C.E. 1967. Plant remains. The Prehistory of the Tehuacan Valley, ed Byers DS (Univ of Texas Press, Austin, TX), pp 220–255.
- Smith, C.E. 1987. Current archaeological evidence for the beginning of American agriculture. Studies in the Neolithic and Urban Revolutions, The V. Gordon Childe Colloquium, ed Manzanilla L (British Archaeological Reports, Oxford, UK), pp 81–101.
- Stellari, G.M.; Mazourek, M.; Jahn, M.M. 2010. Contrasting modes for loss of pungency between cultivated and wild species of Capsicum. Heredity 104:460–471
- Stewart, C.; Kang, B.C.; Liu, K.; Mazourek, M.; Moore, S.L.; Yoo, E.Y.; Kim, B.D.; Paran, I.; Jahn, M.M. 2005. The Pun1 gene for pungency in pepper encodes a putative acyltransferase. - Plant J. 42: 675-688.
- Stewart, C.; Mazourek, M.; Stellari, G.M.; O’Connell, M.; Jahn, M. 2007. Genetic control of pungency in C. chinense via the Pun1 locus. - J. exp. Bot. 58: 979-991.
- Sukrasno, N.; Yeoman, M.M. 1993. Phenylpropanoid metabolism during growth and development of Capsicum frutescens fruits. Phytochemistry, 32: 839–844.
- Suzuki, T.; Fujiwake, H.; Iwai, K. 1980. Intracellular localization of capsaicin and its analogues in Capsicum fruit. I. Microscopic investigation of the structure of the placenta of Capsicum annuum var. annuum cv. Karayatsubusa. Plant Cell Physiol. 21: 839-853
- Suzuki, T.; Kawada, T.; Iwai, K. 1981. Biosynthesis of acyl moieties of capsaicin and its analogues from valine and leucine in Capsicum fruits. Plant Cell Physiol., 22: 23-32.
- Tewksbury, J.J.; Nabhan, G. P. 2001 Seed dispersal: directed deterrence by capsaicin in chilies. Nature 412: 403 – 404.
- Todd, P.H.; Bensinger, M.G.; Biftu, T. 1977. Determination of pungency due to Capsicum by gas-liquid chromatography. Journal of Food Science, 42(3): 660–665,
- Trejo-Gonzalez, A.; Wild-Al Tamirano, C. 1973. A new method for the determination of capsaicin in Capsicum fruits. J. Food Sci., 38: 342-344
- Villota-Cerón, D.; Bonilla-Betancourt, L.M.; Carmen-Carrillo, H.; Jaramillo-Vásquez, J.; García-Dávila, M.A. 2012. Caracterización morfológica de introducciones de Capsicum spp. existentes en el Banco de Germoplasma activo de Corpoica C.I. Palmira, Colombia. Acta Agronómica. 61(1):16-26
- Wyatt, LE; Eannetta, NT; Stellari, GM; Mazourek, M. 2012. Development and application of a suite of non-pungency markers for the Pun1 gene in pepper (Capsicum spp.). Molecular Breeding. 30(3): 1525-1529
- Zamski, E.; Shoham, O.; Palevitch, D.; Levy, A. 1987. Ultra-structure of capsaicinoid-secreting cells in pungent and non-pungent Red Pepper (Capsicum annum L.) cultivars. Bot. Gaz. 148: 1–6.
- Zewdie, Y, ; Bosland, P.W. 2000a. Capsaicinoid inheritance in an interspeciWc hybridization of Capsicum annuum x C. chinense. J Am Soc Hort Sci 125:448–453.
- Zewdie, Y.; Bosland, P.W. 2000b. Evaluation of genotype, environment, and genotype-by-environment interaction for capsaicinoids in Capsicum annum L. Euphytica, 111: 185–190.
- Zewdie, Y.; Bosland P.W. 2001. Capsaicinoid profiles are not good chemotaxonomic indicators for Capsicum species. Biochem. Syst. Ecol. 29:161–169.